I. OBOWIĄZEK RAPORTOWY
Głównym celem ZSMOPL jest usprawnienie procesów biznesowych związanych z dostępem do informacji o obrocie produktami leczniczymi.
ZSMOPL umożliwia Głównemu Inspektorowi Farmaceutycznemu i Ministerstwu Zdrowia wykonywanie, na podstawie przekazanych informacji, analiz w zakresie m.in.:
- procesu wywozu monitorowanych produktów leczniczych poza granice RP,
- stanów alarmowych wybranych monitorowanych produktów leczniczych.
Obowiązek raportowania do ZSMOPL mają podmioty prowadzące obrót produktami podlegającymi raportowaniu takie jak apteki, działy farmacji szpitalnej, przedsiębiorcy prowadzący działalność polegającą na prowadzeniu hurtowni farmaceutycznej oraz podmioty odpowiedzialne.
Tak, technicznie jest to możliwe. Jednak podmiot przejmujący obowiązek raportowy musi posiadać bardzo szczegółowy dostęp do danych raportującego, co wynika z zakresu raportowania.
Zgodnie z ustawą Prawo Farmaceutyczne obowiązek ten spoczywa na podmiocie prowadzącym obrót produktami raportowanymi.
NEUCA nie posiada informacji niezbędnych do raportowania w imieniu apteki, dlatego nie ma możliwości przejęcia tego obowiązku.
NEUCA zapewnia jednak wsparcie dla apteki na każdym etapie tego procesu.
1 kwietnia 2019 r.
Load More
II. PRODUKTY PODLEGAJĄCE RAPORTOWANIU
Produkty raportowane do ZSMOPL identyfikowane są w komunikacie za pomocą:
- Kodu handlowego (GTIN/EAN) – jeśli transakcja dotyczy produktu zawartego w Rejestrze Produktów Leczniczych lub produktu z listy refundowanych wyrobów medycznych i środków spożywczych specjalnego przeznaczenia żywieniowego;
- Numeru zapotrzebowania – jeśli transakcja dotyczy importu docelowego lub interwencyjnego, przy czym numer powinien być zapisany zgodnie ze schematem
- MZ/NNNNN/RR – dla zapotrzebowania,
- D/NNNNN/RR – dla środków spożywczych specjalnego przeznaczenia żywieniowego,
- DOP/NNNNN/RR – dla zgód wydanych na podstawie ustawy Prawo farmaceutyczne art. 4 ust. 8,
- Zgoda/NNNNN/RR – dla decyzji wydanych na podstawie ustawy Prawo farmaceutyczne art. 4 ust. 9,
- gdzie NNNNN oznacza pięciocyfrowy kolejny numer a RR oznacza dwie ostatnie cyfry roku.
Raportowaniu podlegają wszystkie produkty lecznicze, produkty sprowadzone w ramach importu docelowego i interwencyjnego oraz refundowane wyroby medyczne i środki spożywcze specjalnego przeznaczenia żywieniowego, które są w obrocie podmiotu raportującego.
Zarówno Ministerstwo Zdrowia jak i CSIOZ nie udostępniają listy preparatów objętych raportowaniem. Każdy podmiot raportujący na własną odpowiedzialność ustala listę produktów raportowanych do ZSMOPL.
W systemie KS-AOW w module KARTA TOWARU z zakładki INNE, pole CZY RAPORTOWAĆ DO ZSMOPL. Można także posłużyć się informacją zaszytą w bazie BLOZ.
Nie zwalnia to jednak Apteki z odpowiedzialności za zdefiniowanie listy produktów raportowanych do ZSMOPL.
Przy zmianie listy produktów, którymi obraca apteka oraz w przypadku zmian na listach refundowanych wyrobów medycznych i środków spożywczych.
Load More
III. ZAKRES RAPORTOWANIA
ZSMOPL umożliwia:
- przekazywanie danych o obrocie produktami monitorowanymi przez podmioty prowadzące obrót hurtowy oraz obrót detaliczny (komunikat obrotów i stanów),
- zgłaszanie braków monitorowanych produktów leczniczych przez podmioty prowadzące obrót detaliczny (komunikat zgłoszenia braków),
- zgłaszanie planów dostaw przez podmioty odpowiedzialne (komunikat planowania dostaw).
Komunikat zgłoszenia braków produktów leczniczych na rynku obejmuje listę produktów leczniczych na jednym zgłoszeniu zawierającą dla jednego braku:
- Kod handlowy produktu (kod EAN);
- Liczbę brakujących opakowań produktu leczniczego;
- Datę i czas transakcji (stwierdzenia braku).
Komunikat obrotów i stanów zawiera:
- Część nagłówkową – to identyfikacja podmiotu raportującego, jego miejsca prowadzenia działalności i numer komunikatu korygowanego (podawany w przypadku poprawiania już wysłanego komunikatu),
- Dane transakcji w ramach komunikatu – jedna lub więcej transakcji zrealizowanych w raportowanym okresie czasu (domyślnie 1 doba).
W ramach pojedynczej transakcji komunikat zawiera:
- Część nagłówkową transakcji – to identyfikacja drugiej strony transakcji i rodzaju raportowanej transakcji
- Pozycje w ramach transakcji – to jedna lub więcej pozycji odpowiadające pozycjom z dokumentu źródłowego raportowanego do ZSMOPL
Podmiot raportujący w ramach identyfikowania się podaje kilka informacji:
- Nazwę i adres
- Kto raportuje – identyfikator podmiotu raportującego, zależy od rodzaju działalności prowadzi podmiot raportujący, dla aptek identyfikatorem jest REGON (9 znakowy) pozyskany na etapie rejestracji podmiotu.
- Skąd jest raportowane – identyfikatora miejsca prowadzenia działalności podmiotu raportującego, zależy od rodzaju działalności prowadzi podmiot. Dla aptek identyfikatorem jest identyfikator z Rejestru Aptek.
Należy upewnić się, czy dane te poprawnie wpisane są w systemie aptecznym oraz w Rejestrze Aptek.
Należy wskazać dane podmiotu będącego prawnym właścicielem kupowanego towaru, tj. NEUCA S.A.
Druga strona transakcji – dostawca identyfikowana jest przez kilka informacji:
- Nazwę i adres, tj. NEUCA S.A. ul. Szosa Bydgoska 58, 87-100 Toruń
- Z kim zawierana jest transakcji – identyfikator podmiotu, od którego nabywany lub któremu sprzedawany jest towar, zależy od rodzaju tego podmiotu. Dla hurtowni farmaceutycznej (dostawcy) identyfikatorem jest REGON (9 znakowy) pozyskany na etapie rejestracji podmiotu, tj. 870227804
- Skąd dostarczany jest towar – identyfikator miejsca prowadzenia działalności podmiotu, z którym zawierana jest transakcja.
Dla hurtowni farmaceutycznej (dostawcy) identyfikatorem jest identyfikator z Rejestru Hurtowni Farmaceutycznych miejsca wydania towaru
| identyfikator hurtowni | nazwa hurtowni | miejscowość | nazwa ulicy | numer budynku |
| 103535 | Neuca S.A. | Lublin | Inżynierska | 8a |
| 107507 | Neuca S.A. | Gądki | Magazynowa | 7 |
| 103597 | Neuca S.A. | Gdańsk | Miałki Szlak | 52 |
| 103562 | Neuca S.A. | Katowice | Porcelanowa | 72-74 |
| 103556 | Neuca S.A. | Kielce | Batalionów Chłopskich | 91A |
| 103495 | Neuca S.A. | Koszalin | Olchowa | 5 |
| 103467 | Neuca S.A. | Rzeszów | Lubelska | 50 |
| 103508 | Neuca S.A. | Olsztyn | Janowicza | 2a |
| 103629 | Neuca S.A. | Ołtarzew | Ceramiczna | 1 |
| 103480 | Neuca S.A. | Przecław | Warzymice | 33 |
| 109490 | Neuca S.A. | Toruń | Forteczna | 35/37 |
| 108226 | Neuca S.A. | Wrocław | Graniczna | 8a |
| 107903 | Neuca S.A. | Zielona Góra | Wojska Polskiego | 37 |
| 103543 | Neuca S.A. | Nowy Sącz | Węgierska | 148A |
| 109359 | Neuca S.A. | Pabianice | Lutomierska | 58 |
Należy upewnić się, czy dane te poprawnie wpisane są w systemie aptecznym.
Instrukcja uzupełnienia tych danych w systemie aptecznym KS-AOW zawarta jest w pytaniu „Jak w systemie aptecznym KS-AOW uzupełnić dane dostawcy?”
Pierwszy komunikat rozpoczynający raportowanie do ZSMOPL (BO – bilans otwarcia) powinien zawierać informacje o stanach magazynowych każdej serii produktów objętych raportowaniem.
Komunikaty można wysyłać na bieżąco po wystąpienie transakcji, nie później jednak niż kolejnego dnia, którego one dotyczą.
Komunikat korygujący należy wysłać w sytuacji, gdy:
- Raportujący stwierdza jego niekompletność lub błąd w wysyłanych danych
- Komunikat nie wczytał się prawidłowo, lub zgodnie w informacjami zamieszczonymi na portali CSIOZ, zawierał błędne dane.
Load More
IV. KONTO UMOŻLIWIAJĄCE RAPORTOWANIE
Portal środowiska produkcyjnego ZSMOPL jest dostępny pod adresem: https://zsmopl.ezdrowie.gov.pl
WebService: https://zsmopl.ezdrowie.gov.pl/cxf/zsmopl/ws/
Portal środowiska ewaluacyjnego (testowego) ZSMOPL jest dostępny pod adresem: https://ewa-zsmopl.ezdrowie.gov.pl.
WebService środowiska ewaluacyjnego (testowego) ZSMOPL jest dostępny pod adresem: https://ewa-zsmopl.ezdrowie.gov.pl/cxf/zsmopl/ws/
Nie. Wymagane jest uzyskanie nowego certyfikatu wg nowych wytycznych.
W takim przypadku nie trzeba zakładać kolejnego konta na P2. Należy skorzystać z tego, które już istnieje.
Proces podłączenia do środowiska produkcyjnego ZSMOPL składa się z następujących kroków:
– Założenie konta dla administratora lokalnego podmiotu na platformie P2.
– Złożenie wniosku o założenie konta podmiotu raportującego w ZSMOPL.
– Import certyfikatu służącego uwierzytelnianiu danych przesyłanych do ZSMOPL.
Szczegółowa procedura zakładania kont dostępna jest pod adresem: https://www.csioz.gov.pl/fileadmin/user_upload/instrukcje/instrukcja_podlaczenia_do_zsmopl_srodowisko_produkcyjne_5a21b6d566d0c.pdf
Konta potrzebne są w celu uruchomienia i realizowania raportowania między programem aptecznym a ZSMOPL.
Wymagania dotyczące certyfikatu opublikowane na www.csioz.gov.pl:
– zawiera adres e-mail, nazwę reprezentowanego podmiotu i miejsca prowadzenia działalności (opcjonalnie: imię i nazwisko subskrybenta),
– jest zgodny ze standardem X.509 v3,
– jest zabezpieczony funkcją skrótu minimum SHA1 (zalecana SHA2),
– ma minimalną długość kluczy kryptograficznych: RSA/DSA 204 bit,
– jest wystawiany w formacie PEM oraz opcjonalnie w formacie P12.
Akceptowane będą certyfikaty wystawione przez dowolne centrum certyfikacji, zarejestrowane w Narodowym Centrum Certyfikacji: https://www.nccert.pl/
Certyfikat niekwalifikowany potrzebny jest w celu podpisywania komunikatów/raportów wysyłanych do ZSMOPL. Certyfikat szyfruje przesyłany raport, dzięki czemu jego treść jest chroniona przed osobami niepowołanymi.
Informacje o tym, jak uzyskać elektroniczny podpis kwalifikowany znajdą Państwo tutaj: https://www.biznes.gov.pl/przedsiebiorcy/sprawy-online/podpis-elektroniczny-i-profil-zaufany
Profil zaufany można założyć przez Internet korzystając z konta bankowego, lub posiadanego certyfikatu kwalifikowanego, albo w punkcie potwierdzającym, którymi są różne urzędy i banki.
Szczegółowe informacje o tym jak założyć profil zaufany znajdziecie Państwo tutaj: https://obywatel.gov.pl/zaloz-profil-zaufany
Elektroniczny podpis kwalifikowany lub podpis potwierdzony Profilem Zaufanym potrzebny jest, aby móc autoryzować wniosek o założenie konta administratora lokalnego na platformie P2.
- Elektroniczny podpis kwalifikowany lub podpis potwierdzony Profilem Zaufanym
- Konto administratora lokalnego apteki na platformie P2 i konto podmiotu raportującego w ZSMOPL
- Certyfikat niekwalifikowany
Load More
V. KONFIGURACJA PROGRAMU APTECZNEGO
Celem właściwego skonfigurowania danych dostawcy ASTRA ZENECA dla raportowania ZSMOPL należy zaktualizować wersję Kamsoftu (przynajmniej do tej z dnia 29.03.2019).
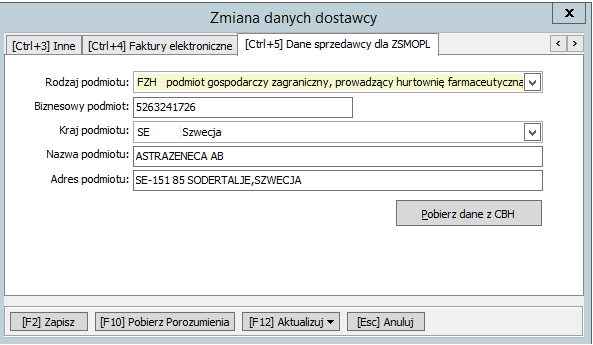
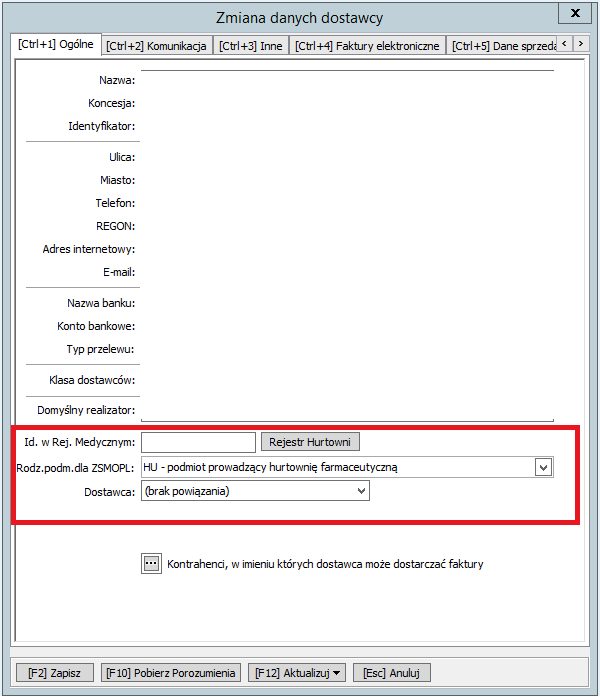
Następnie należy na karcie dostawcy uzupełnić 5 zakładkę „[Ctrl+5] Dane sprzedawcy dla ZSMOPL”wprowadzając dane w odpowiednie pola:
- w polu Rodzaj podmiotu wybrać „FZH podmiot gospodarczy zagraniczny, prowadzący hurtownię farmaceutyczną”
- w polu Biznesowy podmiot wpisać NIP “5263241726”
- w polu Kraj podmiotu wybrać „SE Szwecja”
- w polu Nazwa podmiotu wpisać ASTRAZENECA AB
- w polu Adres podmiotu wpisać SE-151 85 SODERTALJE, SZWECJA
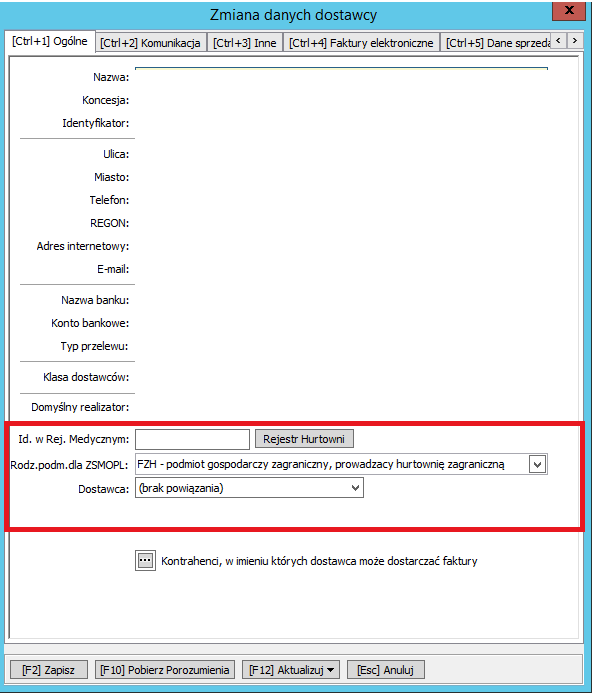
Następnie należy na karcie dostawcy w 1 zakładce „[Ctrl+1] Dane Ogólne” dokonać następującej modyfikacji:
- w polu Id w Rej. Medycznym pozostawić puste pole
- w polu Rodz.Podm. dla ZMOPL wybrać „FZH podmiot gospodarczy zagraniczny, prowadzący hurtownię farmaceutyczną”
- w polu Dostawca wybrać „(brak powiązania)”
- pozostałe pola na karcie dostawcy pozostają bez zmian
Celem właściwego skonfigurowania danych dostawcy dla raportowania ZSMOPL niezbędne jest:
- Pobranie i instalacja najnowszej wersji programu aptecznego (wersje od 29.03.2019)
- Edycja istniejącej KARTY DOSTAWCY (nie ma potrzeby zakładania nowej karty):
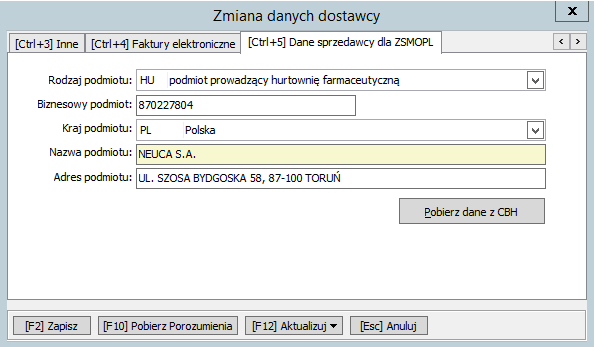
W zakładce nr 5 „[Ctrl+5] Dane sprzedawcy dla ZSMOPL”należy wprowadzić dane sprzedawcy towaru z faktury tj. NEUCA. S.A.:
- w polu Rodzaj podmiotu wybrać „HU podmiot prowadzący hurtownię farmaceutyczną”
- w polu Biznesowy podmiot wpisać REGON (9 znakowy) „870227804”
- w polu Kraj podmiotu wybrać „PL Polska”
- w polu Nazwa podmiotu wpisać NEUCA S.A
- w polu Adres podmiotu wpisać ul. SZOSA BYDGOSKA 58, 87-100 TORUŃ
Następnie należy w zakładce „[Ctrl+1] Dane Ogólne” dokonać następującej modyfikacji:
- w polu Id w Rej. Medycznym wybrać właściwy dla Państwa podmiotu magazyn centralny. Nie należy zakładać karty dla magazynu lokalnego – prawidłowe dane do raportowania będą pobierane
z nagłówka faktury. Informację o magazynie centralnym można uzyskać z faktury lub wpisać nr identyfikatora z listy poniżej:
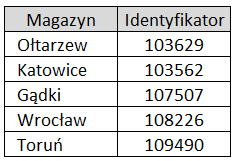
- w polu Rodz.Podm. dla ZMOPL wybrać „HU podmiot prowadzący hurtownię farmaceutyczną”
- w polu Dostawca wybrać „(brak powiązania)”
- pozostałe pola na karcie dostawcy pozostają bez zmian
„Instrukcja podłączania systemu KS-AOW do ZSMOPL” jest dostępna z poziomu głównego okna systemu KS-AOW, w menu „O Systemie”.
Load More
VI. ZGODNOŚĆ FIZYCZNEGO OBROTU TOWARU Z OBROTEM REJESTROWANYM W SYSTEMIE APTECZNYM
Powiązanie serii zgłaszanej w reklamacji z konkretną serią na fakturze zakupu. Nie ma możliwości zwrotu innej serii towaru niż ta widniejąca na fakturze zakupu. Liczba zwracanych produktów nie może przekroczyć liczby zakupionych produktów.
– Wprowadzić do systemu indeks, ilość i serię zgodnie z fakturą zakupu, nawet jeśli jest to niezgodne z fizyczną dostawą.
– Wstrzymać obrót produktu do czasu wprowadzenia do systemu korekty indeksu, ilości lub serii zgodnie z fakturą korygującą zakup.
– Zgłosić reklamację do BOK NEUCA.
– Produkty mogą trafić do sprzedaży w aptece dopiero po uzyskaniu korekty faktury.
Przy każdym wydaniu oraz przyjęciu towaru z/do apteki, a w szczególności:
– przy wydaniu towaru do pacjenta: weryfikacja zgodności wydawanego towaru z wydawanym paragonem/fakturą sprzedaży (nie tylko indeks i ilość, ale także seria każdego opakowania),
– przy dostawie towaru od dostawcy: weryfikacja zgodności każdego kupowanego opakowania towaru z fakturą zakupu (nie tylko indeks i ilość, ale także seria każdego opakowania),
– przy wydawaniu towaru do utylizacji: nie tylko indeks i ilość, ale także seria każdego opakowania,
– przy wydawaniu/odbiorze towaru od dostawcy w ramach reklamacji.
Load More
VII. ZMIANY WE WSPÓŁPRACY APTEKI Z NEUCA
Braki w dostawie dosyłane będą tylko w sytuacji, gdy hurtownia dysponować będzie daną serią leku. W przeciwnym wypadku wystawimy dla Państwa fakturę korygującą.
Reklamacji będzie podlegał tylko towar zakupiony w NEUCA.
Tzw. brak lub błąd serii dla standardowej dostawy rekomendujemy, aby zgłosić do NEUCA w ciągu 48 h od odebrania zamówienia.
Load More
